前回は糖と脂質が結び付いたものを見ていましたが(といっても、ただ名前と構造を出しただけで、何の面白い話もありませんでしたけど)、今回は生物の主役、タンパク質にご登場いただきましょう。
例によってまずはつまんない構造の話から入りますと、とりあえずおさらいですが、前回の脂質の場合、糖分子は、グリセリンのOH、またはスフィンゴシンのOH(糖脂質は、グリセリンかスフィンゴシンかのどちらかにつながるものでした)と、糖自身のもつOHとから(つまり、OH×2から)H2Oが外れることで、残ったOを介して手をつなぐ、グリコシド結合で結ばれていました。
タンパク質の方も、脂質同様、実はつながる相手・場所が決まっています(もちろん、人工的にならどこでもつなげることは可能ですが、「天然で、生体内で」の話ですね)。
タンパク質は、(これももう何度も触れている話ですけど)20種類のアミノ酸が大量につながってできた物質ですが、その20種類の内、糖がくっつくのはわずか3つ!
しかも結合様式によって2グループに分けられて、1つ目のタイプが、窒素原子(アミノ基NH2)を介してつながるアスパラギン、もう1つのタイプが、酸素原子(こちらはやっぱり例によってOH基)を介してつながるセリンとスレオニンになります。
まず1つ目のタイプのアスパラギンにくっつくタイプですが、アミノ酸の構造についてはまた追って別の記事で触れようと思っていたので今回詳しく触れることはしないものの、糖の結合記事にはあまりいい画像がなかったので、アスパラギン自体の画像を貼るとしましょうか。
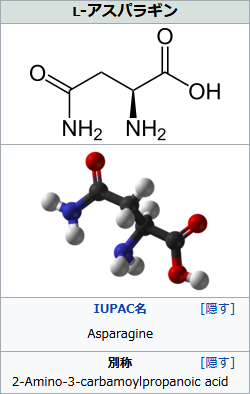
アミノ酸というのは、アミノ基NH2とカルボキシ基COOH(これがあると「カルボン酸」という酸になる)の両方をもつことからまさにその名前も付けられた物質ですが、アスパラギンは、アミノ酸固有の(=全アミノ酸がもつ)NH2の他に、もう1つNH2をもってるんですね。
こいつが、この場合はNH2のHを差し出し、糖のOHを丸っと奪うことでH2Oが外れ(何度か書いている通り、有機化学の反応では、基本的に結合すると水分子H2Oが取れることが多いです。脱水縮合といわれる感じですね。その反対が、加水分解)、窒素原子Nを介して結び付きます。
このアスパラギンに直接くっつく糖は、基本的に必ずGlcNAc(N-アセチルグルコサミン)であり、窒素を介して手をつなぐことからN-結合型グリコシル化と呼ばれますが、心の底からそんな名前なんてどうでもいいでしょう。
言葉だけでは分かり辛すぎるので画像を貼りたいところですが、WikipediaのN-結合型グリコシル化の記事はマクロな話(どういう反応で糖化が進むか、とか、ここからさらにどういう糖がつながるか、など)がメインで、もっとミクロな部分の、アスパラギンと糖(GlcNAc)の結合部分を描いたいい図が存在しなかったので、検索したら出てきたLifeteinという人工タンパク質合成サービスをメインにビジネスをしている会社のページから、結合の構造図を引用させていただきましょう。

(波線「~」は、この隣に他のアミノ酸がつながっているのを省略しているマークですね。)
ちなみにこの会社、僕もタンパク質合成と抗体作成でお世話になったことがありますが、普通に対応も丁寧で製品クオリティも問題ない、とてもいい企業でした(当然、お値段は高かったですけど、タンパク質合成はどの会社も高いですし、むしろ、見積もり取ったらここが底値だった(から選んだわけですけど)ぐらいです)。
関係ないですが、企業による製品解説サイトはめちゃくちゃ分かりやすくて勉強になることが多いですね。
もちろんいつも画像を拝借しているWikipediaも役に立ちますし(たまに、Wikipediaを毛嫌いしている人(特に大学の先生とか)がいますが、どう考えても絶っっ対に有益ですよね。もちろん課題のレポートとかでウィキペコピペとかは論外ではありますが、広く浅く…どころか広くそれなりに深く学ぶ上で、Wikipediaほど優れたものもないと思います)、個人的には、教科書や講義より、企業の実験・試薬解説系ページとWikipediaからの方が学んだことが多かったのでは…?!と思えるぐらいかもしれません。
(まぁそれは大学以降の知識の話で、大学以降(特に理系)は正直、知識は自学自習が基本で、大学は実践の場的な感じもありますしね。)
…と話が逸れましたが、画像の下のやつが、アスパラギンとGlcNAcがβ結合(=糖のリングより、結合の仲立ちをしている元素が上にある結合)でつながった構造図です。
なお、アスパラギン以外にもNH2をもつアミノ酸はいくらでもありますが、なぜかアスパラギンのNH2しか糖の結合には使われない(しかも、タンパク質はアミノ酸が一列につながったものですけど、「アスパラギン」-「プロリン以外のアミノ酸」-「セリンまたはスレオニン」という並びになってるアスパラギンにしかくっつかない)ことが分かっています。
これは、「この反応を行う酵素が、そういう性質(=その3アミノ酸を認識して、反応をスタートさせる)をもってるから」というのがその理由といえますが、なぜそういう性質をもってるのか?は謎ですし、面白い話ですね。
他にも深追いすると、このアミノ酸(タンパク質)の糖化に関しては、ドリコールという二重結合を含む長い炭化水素鎖をもったアルコールの一種に糖が結合することからまず始まり、複数の複雑なステップでアミノ酸への糖化や糖鎖部分の伸長が行われることなどが分子レベルで解明されていますが……

一部の反応だけでこんな感じ↑のキモい図であり、あまりにも複雑であまりにも面白みに欠けるので、深追いはやめておきましょう。
興味のある方は、まさに上の画像を引っ張ってきたWikipediaの記事なんかにとてもよくまとまっているので、そちらをご覧ください。
(なお、分子レベルで様々な反応機構は解明されているけれど、やはり高分子が絡む複雑すぎるシステムなので、まだまだ未解明なこともいっぱいあるのがこの辺の糖修飾の分野ですね。)
一方、2つ目のグループ、OHを介して結ばれる、タンパク質の中のセリンまたはスレオニンに糖がつながる方、先ほどのN-結合型と対比して、OHなのでO-結合型グリコシル化とか呼ばれますが、既に先ほどのLifetein社の画像に出ている通りですね。
アミノ酸を決定付ける共通のアミノ基由来の「>NH」とカルボキシ基由来の「>C=O」の他に、セリンは-CH2OH、スレオニンはCH3-CH-OHがついた(アスパラギンは、-CH2-CO-NH2でした)形のアミノ酸ですが、その固有部分のOHが、糖との結合に使われる感じですね。
こちらは、アミノ酸に直接くっつくのがGlcNAcのみであったN-結合型とは違い、生体内でも様々な糖が、セリンやスレオニンに直接つながった形で見出されています。
どちらのパターンの糖タンパク質も、まだまだ研究の発展途上でありながらも特に医療・医薬品の分野で大きく注目されている分子です。
N-結合型の方は特に自己と非自己の区別うんぬん、つまり免疫に関わる話で、例えば抗体を治療薬として使う抗体医薬で、製品である抗体に特定の糖鎖をくっつけるときに使われるものとしてよく知られています。
一方O-結合型の方はもっと、より疾病一般に深く関与していることで有名で、一例だと例えばセリンやスレオニンにマンノースがくっついた形、O-マンノシル化されたものとも呼ばれますが、マンノースがついた上でさらに正しく糖がいくつもくっついた構造が必要になることで知られているのが、以前も話に出していた難病の1つ、筋ジスに関与するジストロフィン…

こんな感じ↑の正しい糖鎖修飾がジストロフィンを安定化させて筋肉を形成することに絶対不可欠であることが分かっており、この基盤となるO-マンノシル化を正しく行えなくなってしまった人は、土台のマンノースが欠けてしまうせいで続きの糖鎖形成を行えなくなってしまいますから、筋肉分子の相互作用が上手くいかず、先天性筋ジストロフィーを発症してしまうことが知られています。
たった一分子、マンノースをつけられないだけで、タンパク質自体は問題ないのに、機能不全になってしまう…そんな例もあるということですね。
そんな感じで、タンパク質の糖化というのは新しい治療薬・診断方法の開発といった応用研究や、未解明の分子機構解明といった基礎研究の対象としても非常に魅力的で盛んに研究が進められているジャンルですが、少々難しすぎるので、細かい話はその辺にして、目に見えるマクロレベルの、もっと生活に身近な話に舵取りを変えてみましょう。
タンパク質の糖化というのは、何も生体内で酵素が進めるだけの反応ではないのです。
お菓子作りや料理が好きな方であれば恐らくなじみのあるワードでしょう、生体外でも起こるタンパク質の糖化、これは何かといいますと、メイラード反応と呼ばれる現象に他なりません。
この反応は、長い時間をかければ自然に進行しますが、やはり料理でおなじみなことからも明らかなように、加熱することで促進することが知られています。
タンパク質と糖が共存している状況で物質を加熱してやると、キツネ色に変化することは誰でもご存知だと思いますが(肉を焼くと色が変わる、ホットケーキを焼くと色が変わるなどなど)、これは、タンパク質が糖化することで、その結果褐色物質が生じる(メラノイジンという物質。「メイラード」と似ていますが、メイラードは発見者のフランス人Maillardさん由来の言葉で、メラノイジンは色素として有名なメラニン類似物質で、メラニンに関連したものなので、似てるだけで全く無関係です)ことがその理由なんですね。
肉もお菓子も焼きすぎると黒焦げになっちゃいますが、この「焦げ」と「メイラード反応」は分子レベルでは完っ全に異なる話なので、メイラード反応の延長線上に焦げがあるわけではないということは知っておいてもいいかもしれません(まぁ知ってたら焦げを回避できるわけでもないので、別に知らなくてもいいと思いますが)。
焦げというのは、炭素と水素と酸素などから成る炭素化合物を加熱しすぎた結果、炭素以外の元素成分が飛んでしまい、炭素のみが「炭(スミ)」として残る、いわば消し炭になったものであり、あらゆる有機物(固体として存在し、簡単には気化しないもの限定ですが)は、加熱を続けると最終的に炭化します。
一方、メイラード反応というのは、タンパク質と糖が共存しないと絶対に起こりません。
まぁ生体物質(肉とか、小麦粉とか)でタンパク質と糖が共存しないことはほとんどないので想像は難しいかもしれませんが、例えばタンパク質オンリーである、いわゆるプロテインの粉末とかであれば、これはどれだけ加熱しても決してキツネ色にはならず、姿が変わるとしたら超高温の炎の中に置かれ続けて消し炭化するパターンのみでしょう。
確かに、プロテインの粉をフライパンで加熱してもキツネ色になるような気は全くしませんし、例のちょうどいい美味しそうなキツネ色というのは、黒焦げの途中なのではなく、メイラード反応の結果生じているものなのです、ということは何となく想像がつくのではないかと思います。
…というと、「いやいやちょっと待てーぃ!砂糖を水に溶かして煮詰めたら、消し炭ではない、美味しそうな感じで茶色く色づくやんけ!砂糖は糖で、タンパク質じゃないんだろ?…まさか、水はタンパク質だった…?!一体どういうことだ!!」と思われる鋭い方もいらっしゃるかもしれませんが、これは実は、糖は糖で「カラメル化反応」というものも単独で引き起こすことが知られているのです。
なので、料理の過程で美味しく色づくのは、メイラード反応の他にも糖自身のカラメル化なんかも関与する反応ともいえるわけですが、カラメル化の方がより高温で起こるようなので、特に肉を焼く場合とかの肉色が変わるのは、ほぼ完全にメイラード反応の賜物といえましょう(肉は、炭水化物より圧倒的にタンパク質の方が多いですしね)。
Wikipediaには、各種アミノ酸のメイラード反応時における「におい」の違いを表にまとめてくれたデータがありました。

(どうやって調べたのか、ソースが不明ですが)こういうのも面白いですね。
有機化学入門講座で着目すべきは、やはりフェニルアラニンでしょうか。
「フェニル」という名の通り、これはベンゼン環を含む分子、つまり芳香族化合物であるという話も以前書いていましたが、芳香族の名に恥じぬ、100℃あたりでスミレの花の香り、さらに高温でライラックの花の香りと、まさにアロマグループの面目躍如といえましょう。
…ってことで、本当はもうちょいメイラード反応とかカラメル反応とか楽しそうな話をより深く見ていきたかったのですが、例によって例のごとく、もう長くなりすぎてしまったので、この辺にしておきましょう。
あと他にも、「糖タンパク質として、単独で機能していることが知られている分子」なんかにも触れたかったですが、次回見る予定のネタはかなり短い気がするので、スペースが余っていたらオマケでまた次回話に出してみようかと思います。
(スペースがなかったら、却下で没にしても問題ないぐらい、別に面白くも何ともない話ですしね。)