引き続き、いただいたご質問を見ていくことで、ベーシックなイオンやら何やらの話の理解を多少深めてまいりましょう。
最早説明ご無用、コメントはアンさんよりいただいていたものになります。
大変面白いポイントのご質問、毎度本当に感謝の極みです!
陽イオンとか陰イオンとか言い出すとまた更にややこしくなってくるのは明らかではありますが、記事中に「水素イオン=陽子」という記述があったのでふと思いました、、水素イオンに限らず、イオンには陽子と陰子があるんですか?…というか、中性子は聞きますが、陰子は聞かないような…?(陰子はiPhoneの予測変換にも出てきませんでした。)
陽イオン=陽子なのかと思いましたが、陰イオン=陰子でなさそうなのを考えると、どうやら別物ということなのかもですねぇ?
水素イオンといっても、+と−があるのは正しいですか?水の中に存在するのは+の水素イオンということ?−の水素イオンは水の中ではなくどこか(水でない液体?)に存在している?
「陽イオン交換樹脂」とかいうものが出てきていましたが、溶液(水でない液体?)の中のイオン、例えば水素イオンでない陽イオンもキャッチしてプレゼントできる(というか、存在しているという確認です笑)ということでしょうか?
⇒こちらの記事(→イオンを片一方だけ分けるのは難しいよ)で触れていました、まさにその「水素イオン=陽子」といった部分、完全に片手落ちといいますか、不十分な説明になってしまっている気がする……けどあんま本題と関係ないしまぁええやろ、と適当に書くだけ書いてしまった部分になっていました(笑)。
これも、化学系の専攻に進まれた方以外にはもうほとんど聞いたことがあったかすら覚えていないポイントといえましょう(実際中学では踏み込んで習わなかった気がします)、ズバリ原子の構造に関する話ですね。
そもそも原子とは一体何なのか…?
まぁこれも結局目に見えないので、説明を受けてもまた別のよぉ分からん用語が出てくるだけで結局漠然とした話にしかならないわけですが、構成要素を順に見ていくことで、イメージをぼんやりとでも抱いていただける一助になるような説明を試みてみるといたしましょう。
まず、例の「水兵リーベ…」で覚えさせられる、原子が小さい順に並んだ周期表をおさらいしておこうと思います。
Wikipedia大先生からお借りいたしました、よく見るアレですね。
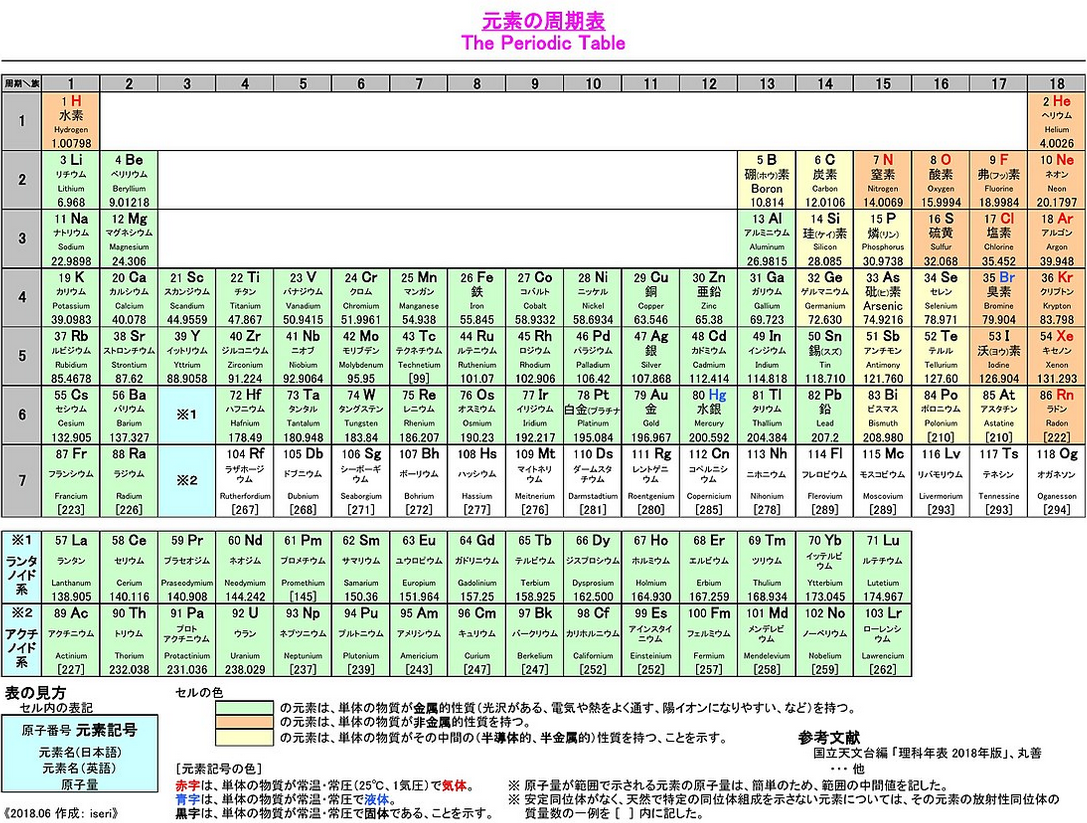
原子番号1番が水素、2番がヘリウム、3番がリチウム…という例のこいつ、今「小さい順」と書いた通り、これは左上から右へ、右端まで達したらひとつ下の行の一番左へ…という感じで並んでいるわけですけれども、これは何を隠そう、大きさ(というか「重さ」の方がより適切かもしれません)の順に原子を並べた表になります。
…と、「重さの順と考えた方がより適切」と書いたものの、実はさらにもっと分かりやすいというか極めて単純明快な視点がありまして、ズバリ、原子番号というのは、陽子の数になっているのです。
どういうことかというと、原子番号1番の水素というのは何てこたぁない、陽子が1つからなる原子であり、原子番号2番のヘリウムは陽子2個からなる原子、以下同様に、例えば原子番号8番の酸素は陽子を8つ持つ原子だし、原子番号82番の鉛は陽子が82個集まってできた原子である…と、そういう話になっているのです。
陽子というのはもちろん、目に見えないほど小さい粒であるため、「これが陽子一粒ね。形はこう」と取り出して示すことは極めて難しいものの、この世にちゃんと実体をもって存在する粒であり、その質量は約1.6726×10-27 kg(指数を使わず書き下すと、0.0000000000000000000000000016726キログラムですが、やはりこういう小さすぎる数は0並べ表記だと分かりにくいにも程があります(笑))と、偉い人が頑張って体重測定をした結果判明しています。
クソ小さい(軽い)にも程がありますけど、ちゃんと重さのある物質だということですね。
したがって、陽子の個数が多いほど「重い原子」であるといえ、もちろん、実体のある粒子が多いほど大きさも大きくなるといえますから、周期表というのは「原子の大きさ・重さの順番に並べたもの」ともいえるわけですけれども、一番分かりやすいのはやっぱり、「陽子の個数が1つずつ増える形で並んでいる」というものではないかな、と思います。
で、陽子というのは名前の通り……つまり「陽イオン」という名称から推測できる通り、これはプラスの電気を帯びた粒子になっています。
もちろん陽子はどれも全く同じものであり、陽子8個の酸素原子は陽子1個の水素原子の8倍プラスの電気をもっていることになるわけですが、しかし、空中に存在している酸素や水素は電気を帯びていません。
…改めて、水中で「イオン」という形で単独の粒子として電気を帯びることはありますが、原子そのものや、安定した分子ではいうまでもなく電気的に中性になっています。
というわけで、もちろん当然の話として、原子は陽子以外に「マイナスの電気をもつ粒子」も一緒に保有することで、「原子自体のトータル電気量はプラマイゼロ」になっているといえるんですね。
そして、その「電荷マイナスの粒子」というものは、普通に考えたら「陽子」と対をなすものということでアンさんのおっしゃられていた「陰子」になるかと思いきや、実はこれは、まさかの、よりおなじみな言葉だと思われる、「電子」というのがその(「陽子」と対をなす)マイナスの電気を帯びた粒子なのでした!
そう、先ほどの「1個の陽子からなる水素原子」というのは実は不十分な記述だった(というかまだ全部を述べ終えていない)感じでして、水素原子というのはさらに電子を1個持つことで、電気的に偏りのない、安定した「水素原子」として存在しているといえるんですね!
つまり、水素原子は「陽子1個と電子1個からなる物体」ということができ、この水素原子から電子1個が飛び出して失われたものは……これはもう簡単にご推察可能のことでしょう、マイナスの粒子がいなくなって電気的にプラスになったそれを、我々は「水素イオン」と呼び、 H+と表しているのです。
…で、ここでよく見てみると、「陽子1個と電子1個からなる物体」から電子1個が失われたらそれは何者かというと、これはズバリ「1つの陽子」に他ならないので、何てこたぁない、水素イオンというのは、「陽子」そのものに過ぎないのである、という話になるのでした。
と、ちょっと話を脱線して、以上の話から「原子番号2番のヘリウムは、陽子が2個なら、電子も2個なんだね。じゃあ、ヘリウム原子というのは水素原子の2倍の重さってこと?」と思えるわけですけど、実は原子には電気的にプラスな「陽子」と電気的にマイナスな「電子」の他に、もう1つ別の粒子が存在するのです。
それが、アンさんもコメントで書かれていましたが「中性子」と呼ばれるもので、これは(まさに名前の通り)電気的には偏りのない中性の粒子ですが、重さだけは陽子とほぼ同じぐらいのものがある形になっています。
正確には約1.6749×10-27 kgで、微妙~に陽子よりも重くなっているものの(陽子の約1.0014倍)、ほとんど同じと考えて問題ない感じですね。
また、一方、電子というのは陽子&中性子と比較するとめちゃくちゃ小さい粒であることも高校で習う重要事項といえましょう。
具体的には約9.1094×10-31 kgになりまして、陽子の重さと比べると約1800倍の差があることになります。
つまり、2キロのペットボトルに対してわずか1グラム程度、1円玉1枚ぐらいの重さしかないわけで、基本的に電子の重さは無視できるレベルとなっている……というか多くの計算問題なんかでは無視して考えるといえる感じですね。
(…って、個人的にはもっと圧倒的な差があると思ってたんですが、案外、2リットルペットボトルに対して1円玉って、必ずしも知覚できないレベル程の差ではない気もしますね……でもまぁ、計算上は無視しても問題ないといえましょう)
つまり、原子の体重は、「陽子の数+中性子の数」で決まっているといえる話になっているのです。
そこで、最初に貼った周期表を再チェックしてみましょう。
(あんまり解像度の高くない画像で、さらにブログにアップするとより潰れて非常に読み辛いかもしれませんが)例えば一番左上の水素、こちら、「1 H」の下に「水素 Hydrogen」という名前があるわけですが、さらにその下に「1.00798」という数字が掲載されています。
実はこれが原子の体重で、これは、「陽子1つの重さを約1としよう」として換算された、いわば「一番小さい水素を1とした相対体重」というものになります。
(小数点以下がありますが、これはまたちょっと複雑な話になるので、後回しにしましょう。
現時点では、「約1」なので、「水素は陽子1個の重さになっているね」と考えていただければと思います。)
それを踏まえて原子番号2番のヘリウムを見てみますと、こいつの体重は「4.0026」、小数点を無視して、約4ということが分かります。
ヘリウムには陽子が2つ(原子番号と同じ)でしたから、なぜ「水素と比べて陽子の数が2倍」のはずのこいつが体重は4倍かといいますと、これはもちろん、ズバリ「陽子2つの他に、中性子を2つ保有しているから」だといえるんですね!
次のリチウムであれば体重は6.968、つまり「約7」で、このことから分かるのは、「リチウムは中性子を4つ持っているんだな」ってことになるわけです(なぜなら、リチウムの陽子の数は3なので)。
もちろん他の全ての原子でも同様で、原子番号6の炭素の体重は約12=中性子6つ、8番の酸素の体重は約16=中性子8つ含む……といった具合です。
周期表を見ればわかりますが、原子番号=陽子の数と体重が一致しているものは存在しないため、実は、水素を除く全ての原子は、中性子もいくつか保有している、逆にいえば「水素原子のみが、陽子と電子からのみ構成されていて、中性子を1つも持たない」といえるんですね!
ちなみにこの「原子の体重」は、実は、正式にはこないだ見ていた「原子量」のことであり、原子量は何だったかというと、「その原子1モルあたりの重さ」でした。
ということで、実は先ほど「陽子1個の重さを1としよう」と書いたのですが、厳密な定義はそうではなく、正確には「炭素原子1モルの重さを12として、それと比べた数値」というのがよりちゃんとした考え方だといえるものの、炭素には陽子6個中性子6個が含まれているので、まぁぶっちゃけ「陽子1個の重さを1」と考えても全く問題ない感じですね。
ここで、どう考えても「何でや!」と思えるであろう、「なぜ炭素原子1モルの重さを12として、それを基準に考えるのか?」については、これも先ほど後回しにしていた原子量が小数点で表されている点にちょろっと関わってくる話になります。
…と、その点含め、ここから改めてご質問されていたポイントに入っていくつもりが、周期表~原子の構成・重さの話で無駄に長くなってしまいました。
これまた時間が尽きてしまったこともあり、上述の「原子量が小数点で表されている理由」の他、続きはまた次回とさせていただこうと思います。