前回の記事では、DNA回収手法として名高い「エタ沈」の友といえる、代表的な共沈剤、グリコーゲン・LPAについて、両者の違いを示してくれている論文を簡単に紹介していました。
どうでもいい小ネタとして、glycogenは英語だと「グライコジェン」と読まれるので、それに則るとお菓子のグリコはグライコになっていた可能性もあったかもしれないといえますから、これは響き的にグリコほど優れてはいませんし(まぁ、慣れがあるだけかもしれないものの)、英語読みに引っ張られなくてよかった…という例といえるかもしれませんね。
では、ようやく宣言通り、フェノクロ・エタ沈の各ステップについて、まぁ実際にやる人がいらっしゃるとは到底思えませんけど(笑)、せっかくなのでちょっと補足を入れていこうかなと思います。
こないだのプロトコルまとめ記事の再コピペですが、各工程から順に、補足するポイントがあるものをピックアップして見ていこうかなと思います。
1. サンプル=細胞懸濁液を用意する
Add 700 μl lysis buffer into cell pellet and resuspend cells
=700マイクロリットル(0.7 mL)の溶解液を細胞のカタマリに加え、細胞を懸濁する
これ、細胞を700 μLの溶液で懸濁していますけど、まぁこの実験例ではどうやらそこそこ大量の細胞から始めていたようで、フェノクロ&クロロホルムステップを執拗に、合計5回ぐらいやっていましたし、「フェノクロを加えて、遠心して上層を回収する」というステップを繰り返すごとにDNAが溶け込んだ水溶液の体積は確実に減っていきますから…
(これは、「タンパク質が除かれて、その分体積が減る」という反応上の理由もありますし、「上層の液体全てを吸うことは不可能なので、一部どうしても取り残しが発生してしまうから」という手技上の理由もありますね)
…まぁ最終的には恐らく半減近く、多分400 μLぐらいにまで減ることを見込んでこの分量で始めているのかもしれませんが……
実際、前回もちょこっと書いていた通り、フェノクロ・エタ沈をよく行う「PCRや各種酵素反応を行った後」みたいな状況であれば、フェノクロは1回で十分なレベルですし、上手い人が扱えばそれこそ99%ぐらいは回収できるので、僕なら多くても400 μLの体積でスタートします。
なぜ400 μLかといいますと、この手の実験で使うチューブ(エッペンチューブとか呼ばれますが、より一般的には「マイクロ遠心チューブ」って感じですかね)は、大体1.5 mLが最大容量であり、エタ沈時には「2.5倍量のエタノールを加える」という話でしたので、DNA溶液が400 μLの場合、2.5倍の1 mLのエタノールを加えるということで、これで合計1.4 mL、さらに1/10の塩を加えることも多いですから、ちょうどチューブのMax容量まで液体が入ることになるからなんですね。
要は400 μLぐらいが1本のチューブで抱えられる限界ということで、例えば500 μLのボリュームで始めてしまうと、塩を1/10量の50 μL、エタノールを2.5倍で1250 μL加えることになり、合計1.8 mLとなりますから、ある程度1.5 mLより多少は余裕を持って加えられるチューブでも、これでは絶対に溢れてしまいます。
なので、単純に「1本のチューブで完結するため」という利便性の都合にはなりますけど、後のエタ沈ステップを見据えて、フェノクロは400 μLのサンプルで行うことが多いです。
(といっても、それは「最大」であり、酵素反応なんて10 μLとか20 μLとかで行いますから、その場合はもっと小さい体積で行うことも十分あり得ます。
…とはいえしかし、10 μL(と言ってもあまりイメージが湧かないかもしれませんが、まぁ10 μLは、中ぐらいサイズの雫が一滴ぐらいですね)だと逆に少なすぎて、遠心後の上層を回収する際にピペットで吸うのが困難になるため、あえて水を加えて体積をアップさせてやるのが必須です。
(というか、「吸うのが困難」というのもありますが、小さすぎる体積だと「ロスが大きすぎる」という現実的な問題もありますね。
上層をピペットで吸う際、先ほどもチラッと書いていた通り、どう頑張っても絶対に全部は吸えず、ごく一部は残ってしまうわけですが、まぁ例えば5 μLはどうしても残ってしまうとすると、10 μLの溶液で始めていたら実に全体の半分、50%も捨ててしまうことになっちゃいますけど、これを400 μLまで水でカサ増ししておけば、5 μLを吸えずに捨ててしまっても、それはわずか全体の1.25%、約99%は回収に成功できると、単純計算でもそうなるわけです。))
そんなわけで、まぁ大体200 μLもあれば扱いやすさ的にも十分ですし、試薬の節約(まぁエタノールなんて全然高いもんじゃないですけど、一度に24本のフェノクロ・エタ沈を行うような場合、DNA 200 μLと400 μLとでは、使うエタノールの量は1本あたり500 μL=0.5 mLの差が生まれますから、合計12ミリリットルも余計に使うことになるので、まぁ事実上何の違いも存在しないのに、もったいないっちゃもったいないですしね)…という意味でも、僕は200 μLの溶液でフェノクロを行うことが一番多いかな、って気がします。
もちろん、大量の細胞から始めるなど「汚いサンプル」の場合、邪魔なタンパク質を除くためにより多量のフェノクロと混ぜる必要がありますし(また、一回では除ききれないので、フェノクロも複数回やった方がいい)、その場合は400 μLとか、(引用動画でもそうされていた通り)フェノクロ処理を繰り返して減っていくことを見越して700 μLとかで行うこともありますけど、改めて、よくやられる「酵素反応やPCR後、反応液の中に微量含まれる酵素を壊すために行うような実験」では、200 μLの系(かつ、フェノクロ1回)で十分すぎますから、僕は200 μLで始めるのがスタンダードなイメージがあると、まぁそんなのは個人の好みな話にすぎませんけどね。
最初の体積が大きいほど理論的なロスは確実に小さくなりますから、1本のチューブで扱える最大が400 μLいけるなら400で始めた方がいいとはいえるものの、試薬の節約のみならず、多検体を扱う場合は体力も重要ですしね(当たり前ですが、2倍の量を吸うには、まぁ2倍疲れるなんてこたぁないですけど(笑)、より大きな労力が必要になります)、無意味に大きな系で実施する意味はあまりないといえましょう。
2. フェノクロ溶液を加える
Add 700 μl Phenol/Chloroform/Isoamylalcohol (25:24:1)
=700マイクロリットル(0.7 mL)のフェノール/クロロホルム/イソアミルアルコール(25:24:1の比でミックス)を加える
で、続いてはDNA(他、細胞に含まれる酵素や生体分子といった夾雑物)が溶け込んだ溶液にフェノクロを加えるわけですけど、教科書的には「DNA溶液の等量」ってのがスタンダードであるものの(この場合は、ステップ1同様、700 μLですね)、これまたサンプルの汚さに応じて変えてやって問題ないものだと思います。
(エタ沈時の塩やエタノールは、「それが沈殿を発生させるために重要な濃度」なので勝手に量をいじれませんけど、フェノクロはあくまで「除タンパク」で、相分離すればいいだけですから、少なくても全く問題ありません。)
実際、「僕は200 μLの溶液で始めることが多い」と先ほど書いていましたが、微量の酵素を加えて行っただけの反応後にフェノクロ処理をすることが多い=サンプルは別にそんなに汚くなく、むしろ多少でもフェノールと混ざって酵素がぶっ壊れてくれればそれでOK…って状況なこともあり、等量より少なめの、150とか100 μLしか加えないこともままあります。
そこも、フェノクロをケチっている…という理由もまぁありますけど(笑)、他にも、「フェノール層が少ない方が、上層を回収しやすい」という実用的なポイントもあるのです。
具体的には……こないだの動画のスクショはあまりチューブの様子がはっきり映っていなかったので、何かいい画像はないか「フェノールクロロホルム 相分離」で検索したら、論文紹介サイトの自動翻訳記事でしたが、そこそこ読めるレベルの日本語だったのでFigureレジェンド(=説明文)含めスクショを撮らせていただきました、こちらの画像(↓)がめちゃんこ分かりやすいですね!
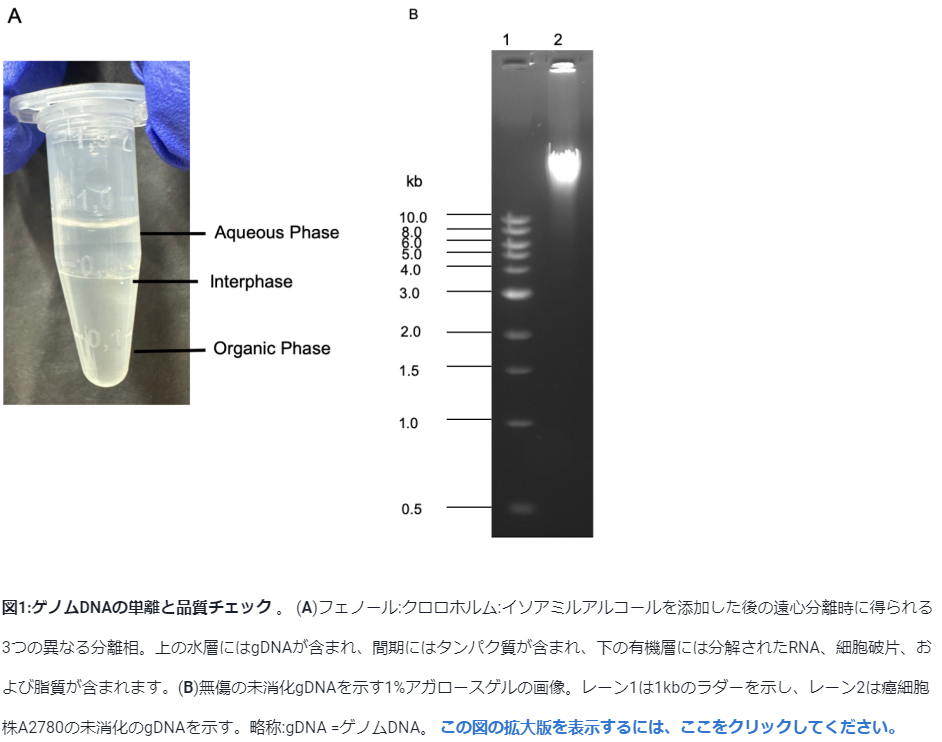
そう、マイクロチューブっていうのはこの図Aのように円錐型(途中からですが)になっていまして、底に行くほど狭い形になっています。
まさにこの写真にあるのが典型的な1.5 mLチューブですが、フェノクロと混ぜて遠心後、液体は2層に分離するわけですけど(中間層は、実際この実験でもほぼ存在していないぐらいなので、層にカウントする程でもないと思います)、Aqueous Phaseが「水層」で上層、Interphaseが「中間層」で、タンパク質が大量にあると白いモヤモヤとして形成されますが僕がやる実験の場合ほぼ「無」で(この画像も、ただの界面にすぎず、改めて「層」って程ではないですね)、Organic Phaseが「有機層」で下にあるフェノール層(「相」とも書かれますが、まぁ「層(幅のある物体)」であり「相(一つの状態)」でもあるので、どちらでもいいでしょう)なわけですけど……
これは多分400 μLのフェノクロを使っていますが(と思ったら、プロトコル本文を見たら500 μLも使ってますね)、この量だと、チューブの真ん中あたり、面積がかなり広がった部分にまでフェノール相が存在していることが分かるかと思います。
まぁ実際やってみないと中々分からないかもしれませんけど、上の水相をピペットで吸っていくわけですが、下層の液面の面積が広いと、最後水の層が減ってくると特に顕著なんですけれども、めっちゃ吸い辛いんですね!
しかし、フェノールの量が少なく、下層がもっと下の方までしかない場合、かなり減っても水相は「層」のままでいられるといいますか、まぁ本当こんなの文字だけで書いてても何のこっちゃで、実際にやってみないと何も実感・想像できないにも程があると思うんですけど(笑)、とにかくフェノール層が少ないほど、圧倒的に扱いやすいのです!
もちろんフェノールが少ないほど除タンパク効果は薄れますけど、もう何度も書いている通り、酵素反応後のフェノクロなんて元々微量の酵素=タンパク質しかありませんから、ちょっとのフェノールで十分なのです。
ってことで、(画像のこのチューブだと、100 μL=0.1のラインはえらい下の方で、流石にそんなちょっとだと少なすぎて不安になるレベルですけど、僕の使ってるチューブだともっとスリムなのか、もう少し上の方まで存在感ある量に見えるので(笑)、「十分だ」と思える量、かつ大変に扱いやすい感じで、僕はフェノクロを100だけ入れて処理することが多い感じです……という、あまりにもどうでもいい実際の実験工程の紹介でした。
ちなみに、ここで水層を限界まで回収するのが腕の見せ所と言いますか、まぁ限界まで吸うとタンパク質も吸ってしまうことになるので教科書的にはあまり推奨されないものの、もうくどすぎますけど微量の酵素しか存在しない反応液とか、下手したらそのまま全部タンパク質が混ざってきても問題ないレベルなので(破壊されて機能さえ失っていれば、混ざってもOKってことですね)、僕はなるべく多くのDNAやRNAを回収すべく、本当に限界まで回収しますけど、不器用な学生とかだと、手が震えてフェノール層を吸ってしまったり、「これ以上は無理だ!」というギブアップが本当に早いことが多いですね。
まぁそこまで頑張って吸わなきゃいけない状況なんてそもそもあんまりないというか、限界まで回収しないと失敗する実験なんて系として良くないんですけど、その辺の回収率とかはやはり腕と経験の差が現れる所かな、と思います。
…ってな所で、あまりにも些末すぎるポイントの補足になってしまいましたが、今回はフェノクロ処理における量についてでした。
次回は、なぜ「フェノクロ(=クロロホルムを混ぜる)」なのか?といった点を見ていこうかなと思っています。