それでは今回もアンさんよりいただいていた、もう大分前の記事へのご質問に遡ってまいりましょう。
今回は、こちらの、電子の流れとかについて見ていた記事(↓)ら辺の話についてですね。
いろいろ質問に答えていただいてありがとうございます。ぼんやり疑問に思っていたことが、どれもわりとスッと入ってきて、なるほど!と思えて、自分の中で繋がった感じになれたものが多かったです。(もちろん、100%理解できたわけではないですが笑)
1番のヒットは、電気の多くは銅の電子を使っているというお話し…!銅の自由電子については、まぁわかるようなわからんようなって感じですけど笑、、小中学時代に自由研究なんかで見かけた、豆電球を光らせる為の剥き出しの装置についていたあの針金がぐるぐる巻きになったやつ(多分コイル)は、恐らく電子を発する為のもの(多分銅)だったということなんですかね?(あ!「どうせん」だから銅じゃん!と思ったんですけど、「どうせん」は導線でしたよね。小学生並みの思考回路でした笑)
⇒銅に限らず、金属は自由電子をもつので必ず電気を通すわけですが…
(そういう風に、電子をいわばカタマリ全体で共有することで原子がつながったものを「金属」と呼ぶので、これは必ずですね。
とはいえ、電気伝導率の一覧(↓)を見てみると、ガリウムやゲルマニウムは極めて小さい値のようですが…
ja.wikipedia.org
(↑の表には数字が表示されていないぐらいですが、小数点以下のレベルの導電率のようです)
…かなり小さくても、一応電気が流れることは流れるということですね。もっとも、こいつらは純粋な金属とは分類されないことも多いですが…(「半金属」など))
…特に銅は導電率が高い&安価なので、小中学校の学習回路に限らず、現実世界の電線とかでも一般的に使われている感じだといえましょう。
ちなみに以前の記事でもちょっと触れましたし、まさに↑のウィ記事の表にもあった通り、銅より導電率が大きい金属は実は銀のみなのですが、イオン化傾向やゴージャスさ(笑)は「銅>銀>金」(あぁ、ゴージャスさは不等号が逆ですけど(笑)、イオン化傾向が小さいほど「輝きを保ちやすい」といえるので、まぁ当たり前ですね)なのに、電気の通しやすさは「銀>銅>金」と、おなじみの3兄弟の順番が入れ替わってるってのは面白いですね。
「どうせん」の字については、僕も書いてて思いました(笑)。
ちなみに今上で書いてた「電気伝導率」と「導電率」も、同じものですがややこしすぎワロタ、って感じですね(笑)。
ではコメント続きに参りましょう。
あと、使われた後の電子は戻ってくるっていうのも、だからコンセントの穴も2つでコンセントプラグも2本になってて、行って帰ってぐるっと回れるようになってるんだ!?とか思いましたけど…そうですか?(っていうか、どこかに書いてあったような気も…笑)
ただ、話が「電場と磁場」となった途端、簡単にはイメージできなくなるんですけどね笑
(『交流回路において、電子というのはほとんどその場で行ったり来たり振動している状態…』は、やっぱりよくわかりませんが、どうやらわからなくてもいいみたいなので、わからないままでいいことにします笑)
⇒コンセントは交流なので本当に複雑なんですけど、基本的にはその考えでOKだと思います。
(参考:チコちゃんによる解説↓)
交流についてはそのまま続きまして…
「交流電源から流れてくる電気…」と書いてありましたが、まず直流と交流の違いもぼんやりとしか分かってないわけですけど、、コンセントにプラグを挿した時に流れてくる電子は交流ということなんですかね?
さっきの豆電球の簡易装置みたいなのは恐らく直流ですよね?(イメージです笑)
あぁ、でも、交流は向きが変化していると書いてあるので、上で書いた「コンセントの穴が2つあるのは、右から入って左から出る為」みたいな考え方は間違ってる感じですか…?いやでも、シャー芯は2つの穴に挿さしてるし、やっぱりそういうこと??(ひとつの穴に2本挿したらどうなるんでしょう?)
とまぁ、交流は特に、ぼんやりどころか真っ白でした笑(↑わからないでいいことにしたはずでは?笑)
⇒「流れてくる電子は交流」というのはちょっと表現がおかしいものの(電子自体には直流も交流もないので、主語の書き方として「電子の流れは交流」みたいな方が適切に思えます)、発電所から電線を経て家庭に届くのは「交流電源」だということですね。
そして電池を使った回路はもちろん直流です。
チコちゃんの解説にもあった通り、交流は+と-がめまぐるしく変化するため、正確には実は「右から入って左から出る」瞬間もあれば「左から入って右から出る」瞬間もあるということで、一定の決まった流れにはなっていないわけですけど(それこそが交流ということですね)、「入口と出口」という考え方そのものは問題ないと思います(ただし、どちらがどちらかは決まっていない、って感じですね)。
「ひとつの穴にシャー芯2本挿し」は……僕はコンセントの詳しい仕組みについて詳しくない、かつ試したこともないので分かりませんが、交流は電位が高速で入れ替わっているということと、2本の芯が形として回路を形成する(難しいですが、先端で交差するような形で)ことも可能であることを考えると、1穴でももしかしたら電位差が一瞬生じて爆発することも、ひょっとするとあるのかもしれません。
(ただ、左の大きい穴の方は電圧が0なので、こちらは多分何を突っ込んでも単独の口からは何も発生しないと思います。あるとしたら、コンセント右側に位置する、小さい口の方ですね。)
とはいえ危険すぎるので、実験するのは絶対やめましょう(笑)。
交流は実際僕もよぉ分からんのでその辺にして(笑)、そそくさとその次の電池の話に進もうと思います。
あと、『電池を使ったら電池は減っていく…』というお話ですが、もちろん、電池は使ったら減るというのはわかっていても、電池の何が減っていくのかなんて具体的に考えたこともなかったですけど(電子が食われてなくなるとかそれすらも考えたことなかったです笑)、なるほど!電圧が下がっていくんですね!!…なんて、そう簡単には理解できませんね、これは笑
電子を動かす為のパワーが、あの電池の中にどんな状態で入ってるんですか?というか、パワーって何?電子を送り出すことができる何かが、あの電池の中に?
とまぁ、ほんとに小学生レベルで何も知らないわけですが、以前の記事で液漏れのことも書いてありましたし、恐らく、化学物質(液体?)が入っていて化学反応を起こす時のなんちゃらがどないかなって…みたいなことではないかと予想します。でもそれって電圧って言うような気がしないですけど…
更に、充電できるタイプの電池となると、コンセントに繋いで、コンセントから流れてくる電子が電池に流れ込むようなイメージですけど、電子は減らないということなら充電によって一体何が電池に足されてるのか…?
もしかしたら過去記事にその辺りもサクッと書かれていたのかもしれないと思いつつ、やっぱり投げてみましたので、もしもの時はコソッと教えてください笑
⇒最早それしか言ってませんが、電池も何気にムズいんですよね(笑)。
特に乾電池やリチウム電池は、少なくとも高校化学の範囲で完璧に説明することは難しく、化学を教えるのがめちゃくちゃ上手かった僕の通ってた学校で使ってたテキストにも、「乾電池の仕組みは、まだよく分かっていないことも多い」とあり、「えぇっ?!こんだけ普及してる電池の仕組みが分かってないって、あり得なくない…?」と全生徒が驚いていたものです。
とはいえ極めて簡単な構造をした、電池の歴史の最初期に発明されたものは大変分かりやすく簡潔なので、今回はこちらを使って電池の基本原理について説明させていただくとしましょう。
高校化学でも当然、電池の話としてその、最初期に作られた「ボルタ電池」と、それをちょっと改良した「ダニエル電池」を習うのですが、実用的な電池は改良型のダニエルさんの方なので、こちらを例に出してみるとします。
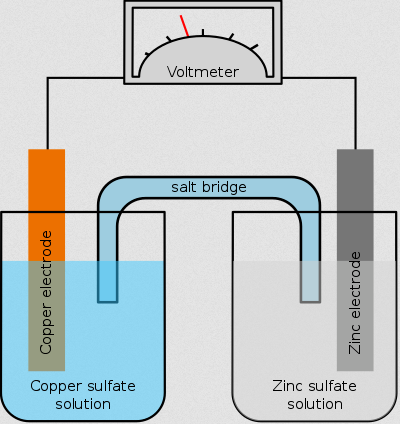
単純な構造といっても(日本語記事のくせに画像は英語版からの転用だったこともあり)微妙に分かりにくいんですけど、構造としては本当に単純で、硫酸銅水溶液に金属の銅板を付けた方が正極となり(画像左側)、硫酸亜鉛水溶液に金属の亜鉛板を付けた方が負極となり(画像右側)、回路を導線でつなげると1.1 Vの電圧が発生するわけですが…
(真ん中にある「salt bridge(塩橋)」は、まぁイオンだけが通過できる橋みたいなものですけど(具体的には「素焼き板」みたいな感じで習いますが、ちょうど植木鉢に使われるレンガのようなもので、水が完全に漏れていくことはないけれど、ジワッと染み込んでいくことでイオンは自由に行き来できる…という都合いい素材が世の中にはあるんですね)、まぁそこは気にしなくてもいいと思います)
…反応式を書くと、
-極: Zn → Zn2+ + 2eー
+極: Cu2+ + 2eー → Cu
というものでして(ちなみに、eーは電子のことですね)、この式を見れば明らかといえましょう、ダニエル電池は、電子の移動により電気を生むことができるんですけど、電気を流せば流すほど金属の亜鉛板は亜鉛イオン(イオンというのは、水に溶けた状態のものでした)となり、逆に銅イオンは金属の銅に戻るということで、明白に「亜鉛が減っている」といえる(逆に、銅は増える)んですね!
まさにその様子が大変分かりやすく描かれているイラストが、EDN Japanの電池解説記事にあったので、お借りさせていただきましょう。

…そう、放電を続けると、亜鉛板(灰色)はやせ細り、逆に銅板(橙色)はでっぷりと太くなっていき(=画像左側)、逆により起電力の高い電池を(正負逆向きに)つないで充電してやると、亜鉛板が復活し、銅板もダイエットに成功する(=画像右側)と、そういう形になっているのがダニエル電池といえるわけです。
とはいえこれは「電池の起電力」に直接関係するものではなく、電気というのはあくまで電気のプラスマイナスという電位差で発生しますから、より重要なものは実はイオンの方、つまり、水に溶けている金属イオン濃度の増減が電池の持続には重要なものであり、具体的には電気を流し続けると、銅イオンが不足していくんですね。
(もちろん、より厳密にいえば「金属の亜鉛板が、イラスト左側のようにやせ細って完全に不足してしまうこと」もあるかもしれませんが、まぁ恐らく電解質(イオン)の方が先に不足(あるいは溶けすぎて、溶液中にそれ以上溶け込めない)って状況が来るんじゃないかな、と思います。)
なので、ダニエル電池を長持ちさせるためには、+極の硫酸銅水溶液の濃度をなるべく濃く、また同時に、「もうイオンになれない」という溶解度に到達するのを遅らせるために、-極の硫酸亜鉛水溶液の濃度は逆にできるだけ薄くして始めるのがポイントになっています。
このダニ電は、水溶液を使うもので当然持ち運びも不便ですしそこまで長持ちもしないものなわけですが、世界初の実用的な電池ということで偉大な発明といえましょう。
その後、通常の運搬では液体が漏れることのない乾電池も生まれ、さらに小型のリチウム電池なんかも誕生して世の中で使われまくっているわけですけど、原則はこんな感じで、いわば電池がやってることはイオンのやり取りだ、ってことなんですね。
(改めて、イマドキの電池はそれぞれかなり色々な工夫がなされているものであり、詳しい仕組みを説明するにはちょっとスペースが足りない……と逃げさせてもらおうと思いますが(笑)、実際本当に全容がまだ分かっていないというのが電池の面白いところで、だからこそ未だに新しいものも開発されてる感じですし、より高寿命・高出力な電池が出てきてほしい限りですね…!)
ということで、電子が増えたり減ったりすることは決してないんですけど(電子はあくまでぐるぐる回るだけなので)、「イオンが増えたり減ったりすることで、電池は寿命を迎える」というのが単純な回答という感じでした。
(電圧を生み出すのも、「イオン濃度の差」に由来するものだといえましょう。
また充電は、イオンの流れを逆向きにしてやる、って話ですね。)
それでは次回もご質問の続きを見ていこうと思います。