ここ最近の記事では、元素の周期表に着目して、その順番やら覚え方やらをペラペラ語っていました。
今回も、もうちょろっとだけ周期表と絡めてベーシックな原子や電子の話を見ていくといたしましょう。
改めて、表があった方が便利なので、Wikipedia記事からお借りした周期表の画像を再掲させていただこうと思います。
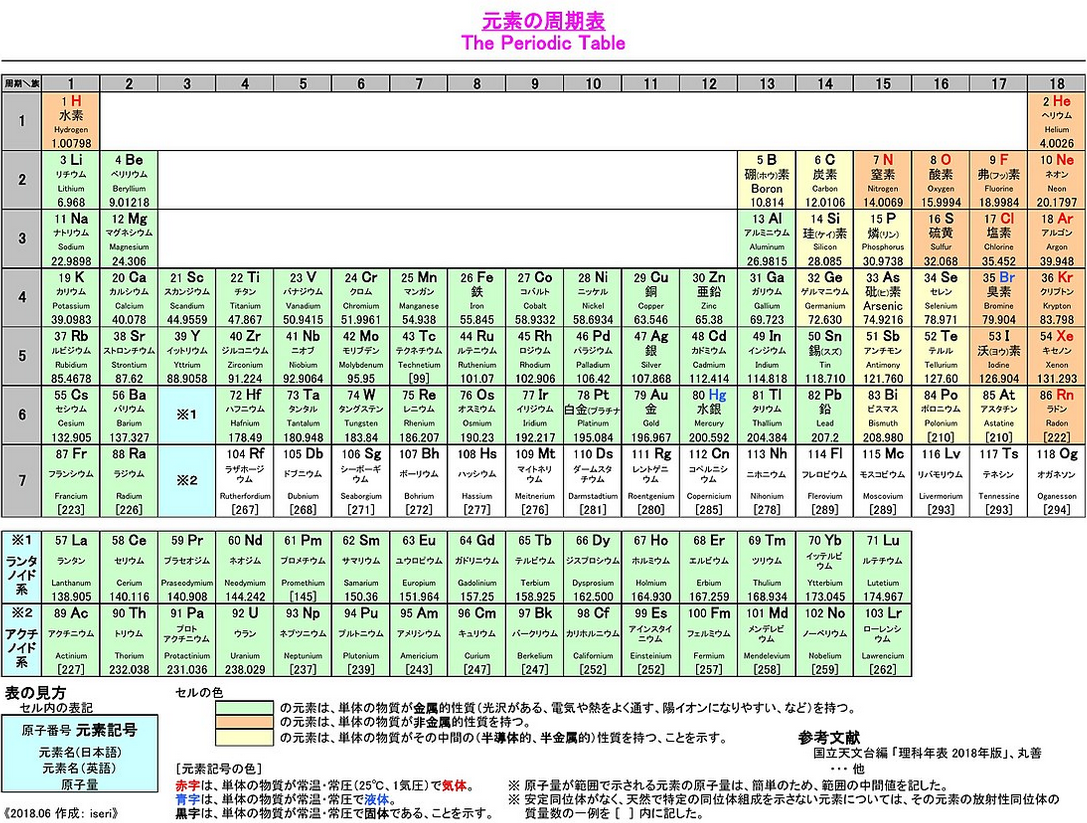
こないだの周期表シリーズ最初の記事(周期表と仲良く(ネオンは貴ガス))で触れていた話からおさらいしておくと、一番右端の18族、貴ガスと呼ばれるこいつらですけど(最後下の2つは貴ガスに分類はされませんが)、このグループの特徴は、「非常に安定な元素で、他の原子とほっとんど反応しない=化合物を作らない」というものだという話でした。
その理由は結局、順番に数えていくと上手いことそうなっている通り、18族の原子は電子殻に電子がちょうどピッタリ安定する形(殻が収められる最大数、または8の倍数)で入っているからであり、これは言い換えると、原子の反応というのは基本的に電子のやり取りになっている、ってことなんですね(だからこそ、既に安定形の極みである18族は、電子を他からもらうこともあげることも好まず、他者と反応しないといえる)。
(電子殻については、こないだのこの記事(↓)で一番よく見ていた感じですかね)
あぁ、各原子の電子配置が全部載っているWikipeida記事(電子殻の英語版)を、↑の次のこの記事(↓)で引用していましたが…
記事中で引用した表の内、黄色い塗りつぶしでハイライトされていたのが18族ですが、よく見てみたらこれ、「8の倍数」というより、最初のヘリウムを除き、全部ピッタリ8個でしたね、一番外側の電子殻に入っている電子の個数は…!
下の方の元素には、電子が増えた結果8より大きい、例えば32個埋まっているものとかもいるんじゃなかったっけ…と思っていたんですが、それは完全に誤解で、普通に全部8個でしたね(もちろん一番外側ではなく、途中の電子殻に32個入ってるのは沢山ありますが、「18族の、一番外側」に限っての話ですね)。
上で貼ったこないだの記事で「8の倍数」としていた部分は、シレッと「8個」に訂正させていただきました(笑)。
そんなわけで、18族には一番外側の電子殻に8個の電子がいるわけですけど、周期表というのは、この「8」という数とのズレが全てのキーだったのです…!
周期表では原子は「陽子の数の順番」に並んでいるという話でしたが、電気的にトータルプラマイゼロになっているのが原子なので、これは言い換えると電子の数の順番でもあるんですね。
それを考慮すると、1つ前の17族は電子が8個から1つ足りない状況、2つ前の16族は2つ足りない状況…であるし、逆に1つ次の左端=第1族は、安定している8個満たされた殻の次の殻に1つだけ多く持っている状況、2族なら2つ多い状況……ってな具合なわけです。
要は、「族の下一桁の数字は、実は一番外の電子殻の電子の個数を表している」ともいえるわけですが、ただ、これは基本的に、第1, 2, そして13~18族のみに言える話になっています。
「え?電子殻が大きくなればなるほど最大許容量が多くなるってことだったから、上手いこと下一桁が一番外の電子殻に入ってる個数になんてならなくない…?」と思えるのももっともで、実際そうはなっていないものもあるわけですけど、そうなっていない部分=そのズレを調整している部分が、第3~12族のいわゆる魔境ゾーン(そんな呼び方僕しかしてませんけど(笑))でして、電子殻の大きくなる第4周期(上から4行目)からはここで上手いこと調節して、13~18族は下一桁が一番外側の電子殻の電子の個数と一致するようになっています。
特に第6・第7周期の第3族には、これまで触れませんでしたが「ランタノイド系」「アクチノイド系」とかいう分類のもと、大量の元素がここに詰め込まれて、上手いこと端数電子が調整されている感じです。
…ぶっちゃけこれ、13~18族が下一桁の個数分電子を持つように並べるためだけの、何か都合よく表をいじってる感もある卑怯くさいやり方な気もしますけど(笑)、上手いこと調節された結果、13族以降はちゃんと一番外の電子殻に「下一桁個」の電子を持っている形になっており、同族の元素(=縦の並び)でそれなりに性質が似ているものを並べることに成功している感じですね。
(とはいえ、下の方の元素はほとんど不安定な放射性同位体しか持たないやつばかりなど、あんまり「同族だから似てる」ってほどでもない気はしますけどね。
結局重要なのは原子番号20番までの元素といえますし(まぁもうちょい大目に見ても、36番第4周期まで)、僕も「後半のやつらの電子の個数は8の倍数じゃなかったっけ?」と勘違いしていたほど印象が薄いですから(なお、「下一桁が電子の個数」という原則を考えたら、すぐに「そんな訳ない」と分かる話になってた気も、今さらながらしてきました。こないだの記事では不注意な記述を掲載してしまい恐縮です)、まぁ後ろの方はあんまり意識しなくてもいいように思えます。)
…と、何だか似たようなことをグダグダ繰り返してるだけになってしまっていますが、改めて、「原子が反応するというのは、ほとんどが電子のやり取りなのである。そして電子は8個安定(もちろん最初のヘリウムだけ2個ですが)」というのが極めて重要なポイントになっていまして、以上を踏まえると、なぜそれぞれの原子が特定のイオンになるかがクリアに見えてくるのです。
例えば第1族は、電子が安定状態から1つ余計に存在しているやつらでした。
したがって、左端にいるこの原子たちは皆、「余計な1つの電子を放出して、安定型になろうとする」性質が極めて強いといえるんですね。
電子はマイナスに帯電していますから、電子を1つ失った原子はプラスの電気をもつ、つまり+1の陽イオンとなるということで、だから、水素はH+だし、ナトリウムはNa+(ナトリウムイオン)になるんですね!
この第1族は(水素を除き)「アルカリ金属」とも呼ばれるグループで、どれも極めて一価の陽イオンになりやすい金属(まぁ水素は最初なので例外ということで、金属ではなく気体ですが)なのです。
言うまでもなく第2族は電子を2つ失うことを強く求めているやつらで(改めて、その結果の電子配置が極めて安定で居心地がいいから)、マグネシウムはMg2+だったし、カルシウムもCa2+という二価の陽イオンを形成するというのは中学でも習った話だと思いますけど、結局電子配置がそれを決定付けているといえるのでした(ちなみに第2族は「アルカリ土類金属」と呼ばれています)。
魔境ゾーンの電子配置はそんなにちゃんとした法則もないので飛ばすとして、右端から見てみると、17族元素は逆に、「あと1つ電子が欲しい…!」という思いを強く抱き続けてるやつらですから、他所から電子を1つ受け取って、例えば塩素はCl-という塩化物イオンを形成しますし、フッ素はF-というフッ化物イオンを形成するってことなんですね。
当然、第16族は「電子2つくれたら安定するぜ!」というやつらで、酸素がO2-なのは結局「安定電子配置を目指す」というそれが全ての理屈だったのです、という話でした。
もちろん第15族ならもう1つ電子が欠けているので、窒素はN3-(まぁそんなイオンはあまり出て来ませんが、アンモニアは一価の陽イオンである水素イオン3つがつながったNH3ですもんね)という三価の元素だといえますが、14族まで来ると、これはもう、安定8個まで4つ増やすのがいいのか4つ減らすのがいいのかどっちとも取れるという形になっているわけですけれども、そんな14族の代表は誰かといいますと、もちろん我らが炭素さま!
この、電子のやり取りに極めて高い自由度を持つという性質があったからこそ、炭素というのは電子を与える側でも受け取る側でもそこそこ働けて、DNA・タンパク質その他、複雑な有機化合物を形成可能な神のような元素になっている…といえまして、本当にその性質のおかげでここまで複雑な分子の形成に成功しているといえる、いわば「炭素の電子バランスの絶妙さが、人間その他あらゆる生物を創り出している」と言っても過言ではないといえましょう。
…と、以上見ていたそんな性質から、周期表では大まかに元素が分けられています。
まず上で見てきた、両端にいる、電子配置がカッチリしており反応性などが分かりやすい感じの元素を「典型元素」と呼んでおり、一方、例のイマイチきちんとした電子配置ルールのない魔境ゾーン、これは「遷移元素」と呼ばれています。
高校までの化学でちゃんと習うのは当然典型元素のみで、しかも登場してくるメインは最初の20個がほとんどって感じですね。
なお、典型元素と遷移元素の境目は12族になっており、魔境ゾーンっぽい12族は分類的には典型元素に入るわけですが、まぁそれはどうでもいいでしょう。
(受験化学では、気をつけないと減点されることもあるものの、実際12族をどっちに入れるかとか、化学専攻の人以外、この世で最もどうでもいいことのひとつだと思います(笑))
あとはせっかくなので周期表上での分類を再度見ておくと、これはちゃんと色分けでもグループ化がされているんですね。
左側を中心に存在する緑色のマスが「金属元素」、一方右側メインのオレンジ色が「非金属元素」で、炭素を中心に例の「どっちつかずで、色んな反応が可能」である黄色マスが「半導体的、あるいは半金属的」な元素と呼ぶ感じですけど、これも改めて、人間が勝手にそう呼んでるだけなので特にどこまでがどうとか気にする必要はないと思います。
ただ、「周期表は、左側に金属、右側に非金属が多い」というのは非常に分かりやすい特徴で、結局陽イオンになりやすい物質は、人間から見ていわゆる「金属だ」と思える物質が多く、一方陰イオンになりやすい物質は、非金属、多くが気体であることが多いわけですね。
(もちろん、常温常圧(普通の環境)で気体なのは赤字の元素なので、非金属元素の全部が全部気体ではないですけどね。)
関連ポイントとして、「~ウム」で終わる元素は金属であり、「~素」で終わる元素は非金属(かつ、漢字というか和名があるものは、歴史的に古くから知られているおなじみのやつらが多いですね)であるというのも、覚えておくと判別しやすい名前の特徴といえましょう。
色々な特徴を見た所で、「結局電子のやり取りって何だよ」という根本的な疑問を感じるかもしれないんですけど、ウィキップ先生にとても分かりやすいGIFアニメがありました。
英語版の「イオン結合」の記事にあったものなんですけど、結局、8個の安定型を目指すために、電子を1個余計に持ってるやつ(1族)は電子を誰かに与えて、一方7個持ちでもう1個欲しがってるやつ(17族)はそれをもらうことで、ちょうどお互いが居心地いい電子配置になり、かつ、電気的にもちょうど+と-で引かれ合うということで、イオン結合というのはズバリこうしてできているものだったんですね!
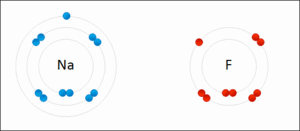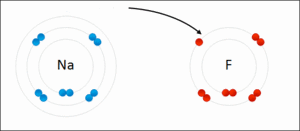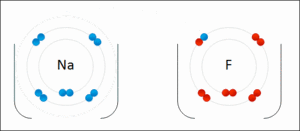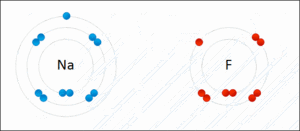
この画像はナトリウムとフッ素ですけど、ナトリウムは電子を1つ放出してナトリウムイオン(Na+)になり、一方フッ素はその電子を受け取ってフッ化物イオン(F-)となる……そして、もちろん電子のやり取りをする以上、両原子(イオン)は非常に近くに存在しているわけですから、電気の力でピッタリと仲良くくっつき、フッ化ナトリウムという化合物を形成する…と、そういう感じになっているのでした。
(正直、フッ化ナトリウムなんて身近にないですし、食塩で画像を作って欲しかったですが(笑)。
一応、日常生活で使われていなくもない物質ですけどね(↓)、どこの家庭にもあるお塩とは、知名度・利用頻度ともに雲泥の差といえましょう)
アイキャッチ画像にも使わせていただいた(とはいえ、アイキャッチはアニメにならないことも多いので、あんまりいい画像ではなかったかもですが)GIFアニメに話を戻しますと、これは大変分かりやすいですね。
結局化合物というのはこうして出来ているといえるのですが、しかし、実はこれは「イオン結合」であり、世の中の分子の多くは、実はもうちょい違うモードの結合を有しているものもままある感じになっています。
もったいぶるほどのものでもなく、一瞬で終わりそうな話でしかないですけど、ちょっとまた時間が足りない感じが続いており、記事水増しのためにも、そちらはまた次回のネタにさせていただきましょう。
その辺の話を終えたら、ようやっとご質問の方に戻って、ベーシックネタもまとめに入っていこうと思っとります。